La Guía Visual de
Reproducción Bovina
- Inseminación Artificial
- Transferencia de Embrión
- Embriones In Vivo
- Fertilización In Vitro
- Embriones In Vitro
Tecnología Reproductiva: Transferencia de Embrión

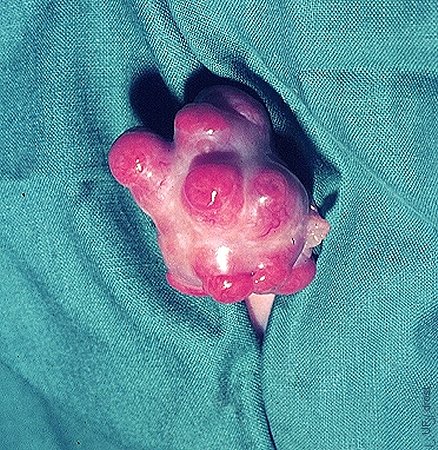
Donadora con Varias Crías.
Vaca donadora Holstein con seis de sus terneros portados por receptoras de carne como madres sustitutas.
Seidel GE (1984)
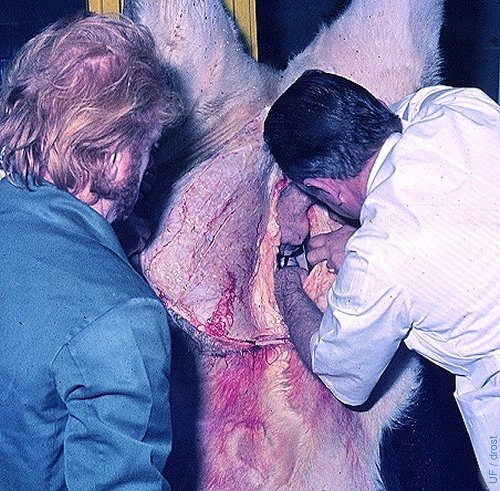
Recuperación en Matadero.
Recuperación del útero y los ovarios desde un animal sacrificado antes de recuperar los embriones.
Brand A (1975)
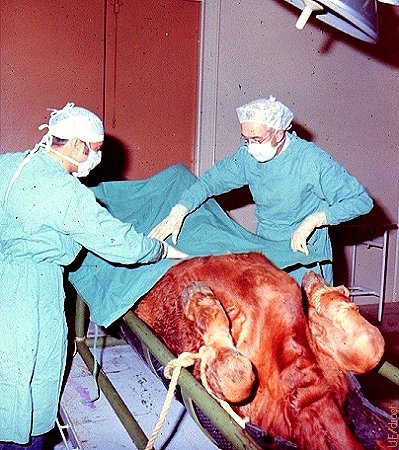
Cubriendo el Abdomen.
Cubriendo el abdomen en preparación para la recuperación quirúrgica de embriones con una donante bajo anestesia general. La cirugía se realiza por la línea media.
Drost M (1973)
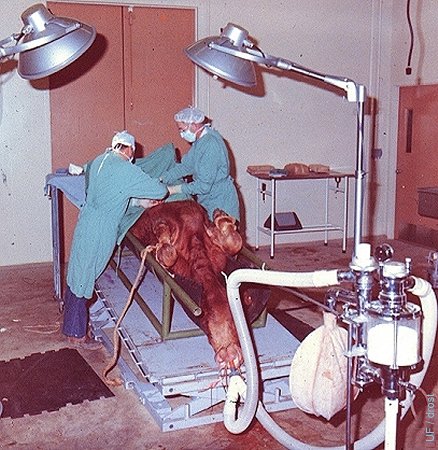
Recuperación Quirúgica.
Incisión por la línea media para la exposición de los cuernos uterinos para la recuperación de embriones de una donante superovulada bajo anestesia inhalatoria general.
Drost M (1973)
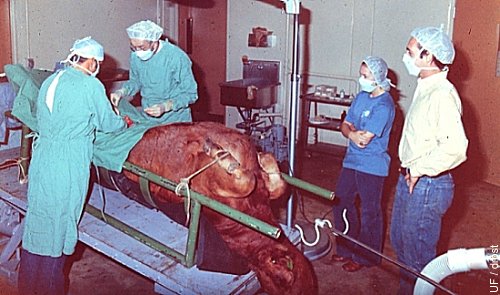
Donadora Bajo Anestesia General.
Donadora en recumbencia dorsal bajo anestesia inhalatoria general. La mesa de cirugía es inclinada para facilitar el acceso al tracto reproductivo por medio de una incisión en línea media justo delante de la ubre.
Drost M (1973)
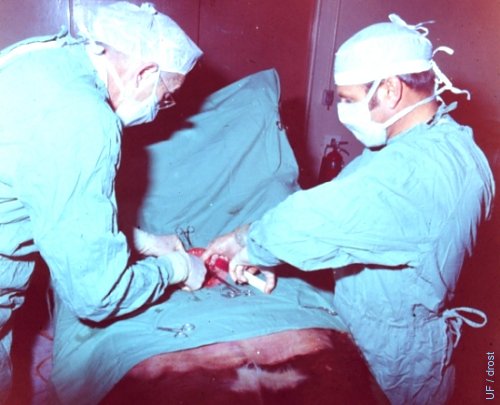
Donadora en Recumbencia Dorsal.
Donadora anestesiada en recumbencia dorsal. Lavado en progreso.
Drost M (1973)
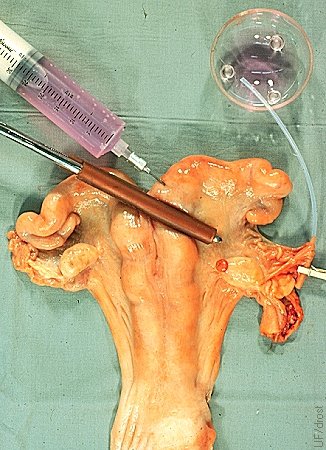
Ubicación del Cateter Oviductal.
La base del cuerno uterino se ocluye con forceps intestinales Doyen protegidos con caucho. Se muestra el sitio de inyección en la base del cuerno. El catéter oviductal se mantiene en su lugar con un gancho miniatura de ropa. Los lavados oviductales se realizan al día 3.
Drost M (1974)
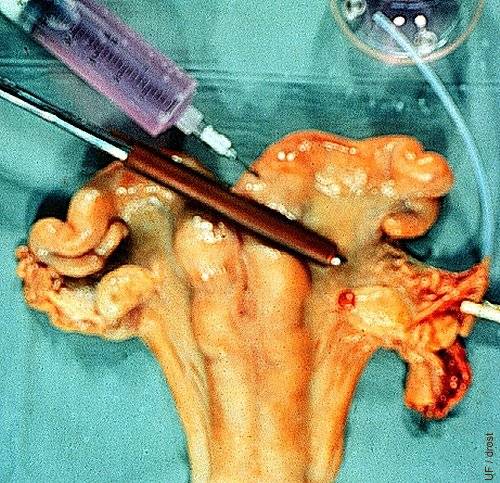
Lavado Quirúrgico.
En esta simulación de una recuperación quirúrgica de embriones bovinos en el día 4, 1) la base del cuerno uterino es prensada con unos forceps (intestinales) Doyen cubiertos de caucho; 2) el oviducto se canula con un catéter OD silástico fino de 2mm; 3) el medio de lavado se inyecta por la base del cuerno para lavar los embriones desde el oviducto a un plato de búsqueda estéril de Cambridge. Note el cuerpo hemorrágico.
Drost M (1974)
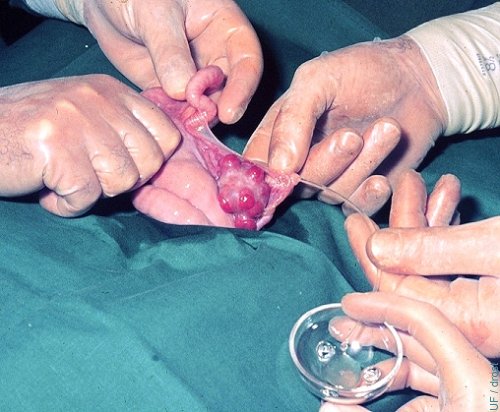
Lavado Oviductal - Superovulación.
Un catéter de Teflón de diámetro pequeño se ha insertado en el oviducto y el cuerno ipsilateral es lavado desde su bifurcación, al día 3 del ciclo de una donadora superovulada.
Drost M (1974)
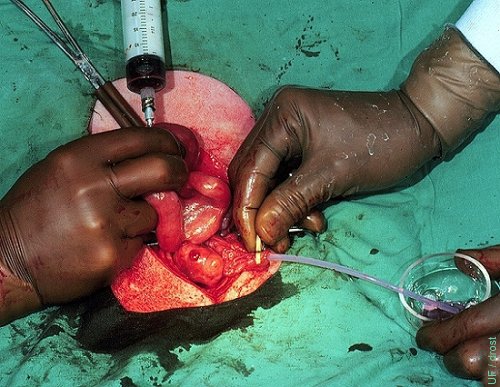
Lavado Oviductal - Ciclo Natural.
Un catéter pequeño de Teflón se ha insertado en el oviducto y el cuerno uterino ipsilateral es lavado desde su bifurcación al día 3 de un ciclo natural. Note el cuerpo hemorrágico.
Drost M (1974)
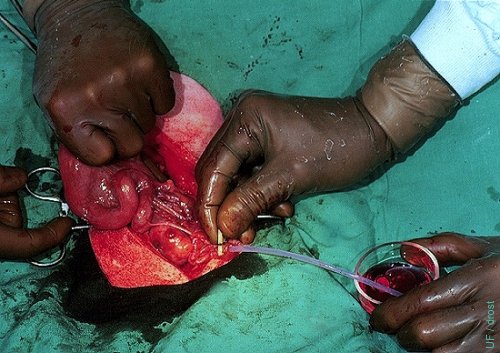
Lavado Oviductal al Día 3.
El medio de lavado se ha inyectado y es masajeado hacia la punta del cuerno.
Drost M (1974)
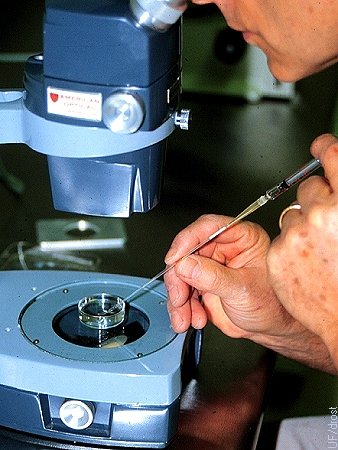
Cargando la Pajuela.
Cargando el embrión desde el plato de mantenimiento en una pajuela de 0.25 cc fijada a una jeringa de tuberculina.
Drost M (1974)

Novillas Receptoras.
Un grupo de novillas Holstein de 15 meses de edad (ciclando) en un corral en el Sur de Florida.
Drost M (1984)

Vacas Lecheras Receptoras.
Vacas lecheras comerciales en un establo con rociadores esperando ser ordeñadas. Las vacas lecheras jóvenes en buena condición corporal son buenas receptoras y se pueden mantener en el hato de ordeño hasta el parto.
Drost M (1984)

Receptoras de Carne.
Un grupo de receptoras de carne en pastoreo en el Sur de la Florida. La vaca al frente y a la izquierda presenta una condición corporal pobre y no sería un buen prospecto como receptora. Ella está probablemente en anestro.
Drost M (1984)

Vaca Jersey Ninfómana.
Esta vaca Jersey es ninfómana. Sufre de degeneración quística folicular crónica y muestra una "joroba" de esterilidad; la base de la cola elevada, debido a la relajación de los ligamentos pélvicos. Las vacas con ninfomanía crónica no son buenas donadoras, ni receptoras.
Drost M (1969)

Vaca Frisona Ninfómana.
Esta vaca Frisona es ninfómana. Sufre de degeneración quística folicular crónica y muestra una "joroba" de esterilidad; la base de cola elevada, debido a la relajación de los ligamentos pélvicos. Vacas con ninfomanía crónica no son buenas donantes, ni receptoras.
Utrecht (1976)
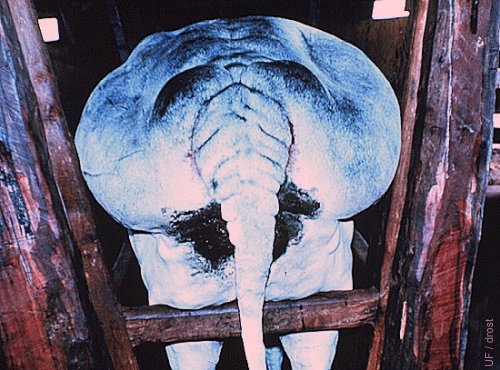
Receptora Excesivamente Obesa.
Esta es una receptora indeseable. Las vacas sobre condicionadas generalmente tienen una pobre fertilidad. La anestesia epidural es difícil de administrar. La palpación del tracto reproductivo es difícil debido a la grasa perirectal.
Drost M (1986)

Vaca Angus con Obesidad Mórbida.
Vaca Angus infértil con obesidad mórbida. Estas vacas son difíciles de palpar debido al exceso de grasa perirectal. No es una vaca apropiada para donadora ni para receptora.
Drost M (1986)

Novilla Limousin Donadora.
Portada del "Canadian Farm Journal" en Dic 1972 mostrando orgullosamente una novilla donadora de embriones y su camada de terneros producidos en British Columbia. Tanto la recuperación de embriones como la transferencia fueron realizados quirúrgicamente.
Drost M (1972)

Donadora Holstein con 8 Terneros.
Vaca donadora Holstein con sus ocho terneros vivos.
Drost M (1984)

Transductor Transvaginal.
Transductor transvaginal con un escáner sectorial y una guía para aguja (7.5 MHz). Este instrumento puede ser utilizado para eliminar el folículo dominante al inicio del tratamiento superovulatorio.
Drost M (1992)

Transductor Transvaginal - Acercamiento.
Acercamiento de un transductor transvaginal con un escáner sectorial y la guía para la aguja (7.5 MHz). La aguja se inserta en el folículo dominante para aspirar el fluido folicular e inactivar el folículo dominante.
Drost M (1992)

Aguja de Aspiración para Recuperación Transvaginal de Oocitos.
Se muestra la guía para la aguja y la punta movible de la aguja de aspiración.
Drost M (1992)
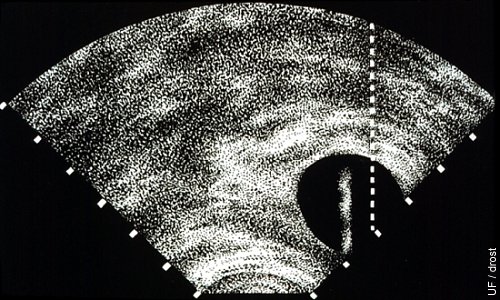
Ablación del Folículo Dominante.
Se utiliza un transductor vaginal con un escáner sectorial. La pantalla está equipada con una línea de trayectoria o de blanco para la aguja de aspiración. El folículo es alineado con la línea punteada después de lo cual la aguja de aspiración es avanzada hasta que la punta se torne visible dentro del folículo.
Drost M (1992)
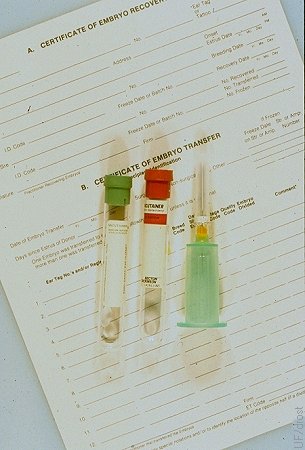
Tipificación Sanguínea de la Donante.
La sangre de las donantes deben ser tipificada para propósito de registro y determinación de parentesco de las crías. Esto debe hacerse antes o al momento de la colecta. Se sabe de algunas donantes que han muerto antes de que sus terneros hayan nacido.
Drost M (1980)
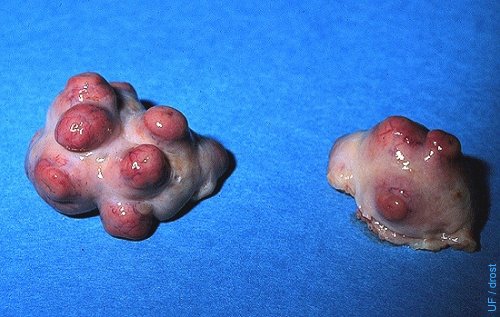
Ovarios Superovulados (FSH).
Buena respuesta superovulatoria: 7 cuerpos lúteos en el ovario izquierdo y (sólo) 1 folículo anovulatorio; 4 o 5 cuerpos lúteos en el ovario derecho. Día 7, tiempo rutinario para colectas.
Drost M (1976)
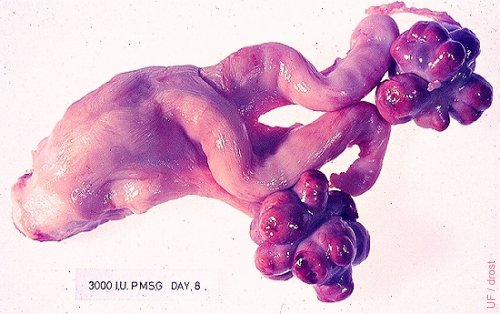
Ovarios Superovulados (eCG).
Respuesta excelente a 3000 UI de eCG (antes PMSG). El ovario izquierdo muestra sólo un folículo anovulatorio pequeño. Tracto de novilla. eCG: Gonadotropina Coriónica equina PMSG: Gonadotropina de Suero de Yegua Preñada
Drost M (1976)
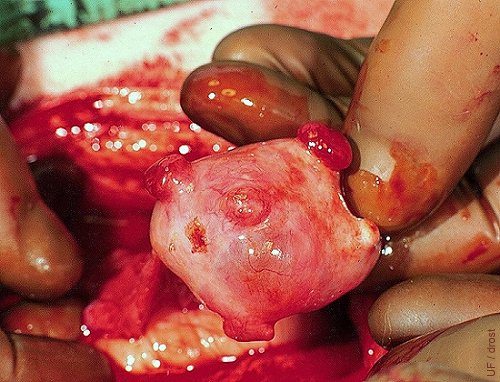
Ovario Superovulado en Día 3.
Tres cuerpos hemorrágicos claramente visibles. También un cuerpo albicans en la parte baja de la punta del dedo pulgar.
Drost M (1973)

Dilatador Cervical.
Dilatador cervical: diámetro 6 mm, 50 cm de longitud con una punta con bisel de 4 cm terminando en un diámetro de 2.5 a 3.0 mm. Hecha de acero inoxidable o aleación de aluminio. Comparada con una pipeta de inseminación estándar de 45 cm de longitud.
Drost M (1984)
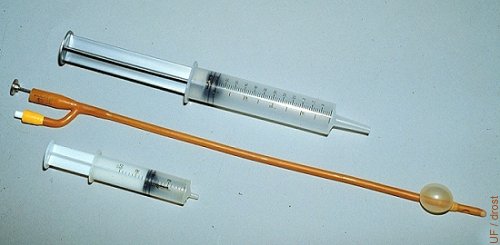
Catéter Foley.
Los catéteres de Foley son catéteres urinarios humanos con balón. Estos son de 45 cm de longitud y el diámetro varía desde 12 French gauge (1 French gauge = 0.3 mm) hasta 24 French gauge. El más comúnmente utilizado en vacas es el de 20 French gauge, mientras que en novillas se utiliza más el de 16 French gauge. El balón se distiende con aire o con medio de lavado; aproximadamente 15 cc en vacas, aproximadamente 12 cc en novillas.
Drost M (1976)
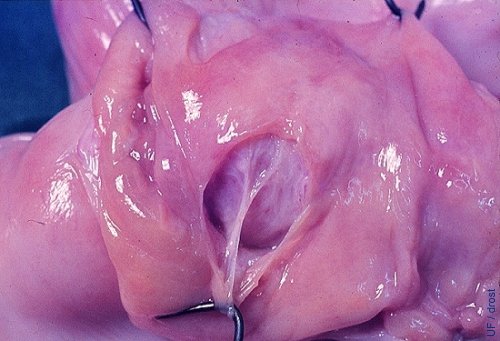
Daño Endometrial.
El endometrio se puede separar cuando el balón del catéter de Foley se sobre distiende. Cuando esto ocurre el medio de lavado infiltrará la pared del útero de donde no se puede recuperar. La hemorragia complicará aún más la recuperación de los embriones.
Drost M (1975)
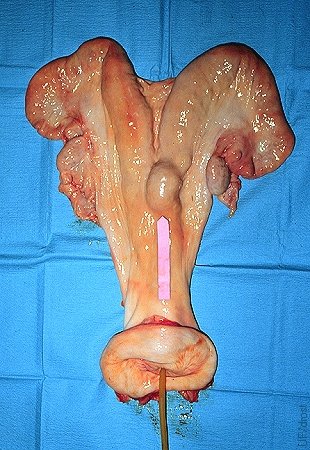
Ubicación del Balón.
La distensión local en la base del cuerno derecho indica la localización del balón inflado.
Drost M (1975)
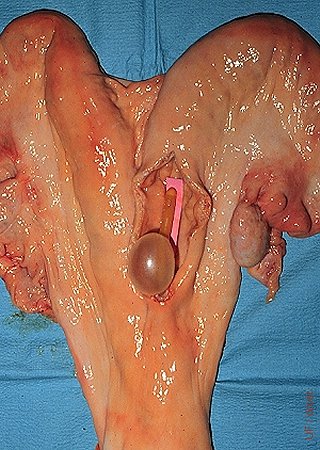
Localización del Balón.
El balón se coloca en la base del cuerno para un lavado unilateral.
Drost M (1975)
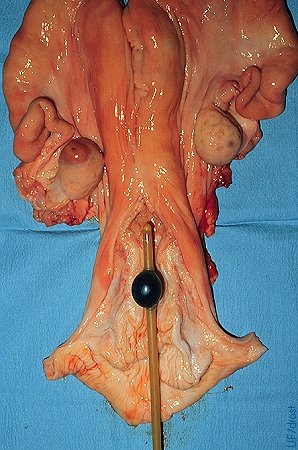
Lavado Uterino Bilateral.
El balón se puede ubicar en la porción anterior del cervix con la punta del catéter en el cuerpo uterino para lavar ambos cuernos al mismo tiempo. El inflado del balón en el cervix genera más resistencia, comparado con la ubicación en el útero.
Drost M (1975)

Lavado Uterino no Quirúrgico.
Día 7, lavado no-quirúrgico por flujo por gravedad. La mano libre del palpador controla la entrada y salida del fluido. El efluente es pasado a través del filtro / concentrador de embriones. Se utiliza rutinariamente un litro de fluido. El nivel de fluido en el filtro de embriones es controlado con la pinza azul.
Drost M (1995)

Elevación del Brete.
Los bretes se han elevado levemente en la parte posterior para que las vísceras se desplacen hacia adelante y sean más asequibles durante la transferencia quirúrgica.
Drost M (1975)
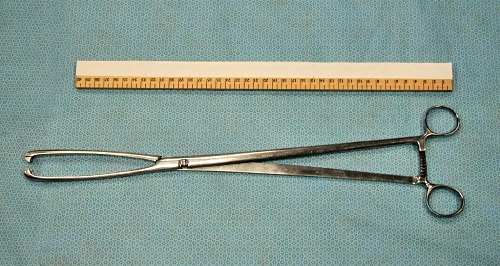
Forceps Cervicales.
Forceps cervicales (45 cm de longitud) para la retracción del cervix de un útero penduloso, para facilitar la ubicación del catéter de lavado.
Drost M (2009)
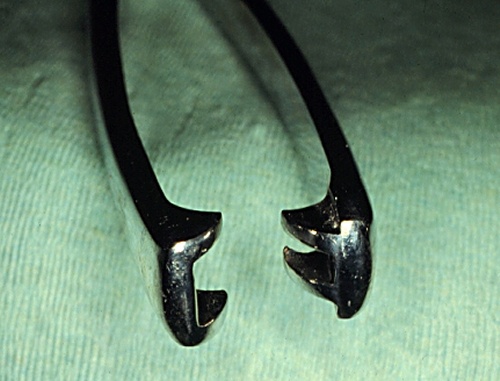
Mandíbulas de Forceps Cervicales.
Mandíbulas relativamente atraumáticas de unos forceps cervicales largos.
Drost M (1975)
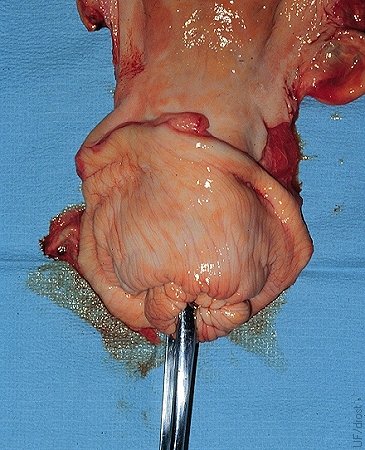
Aplicación de Forceps Cervicales.
Sólo un extremo de los forceps se inserta dentro del cervix haciendo una mordida profunda y firme para evitar el desgarro de una pequeña pieza de tejido durante la retracción.
Drost M (1975)
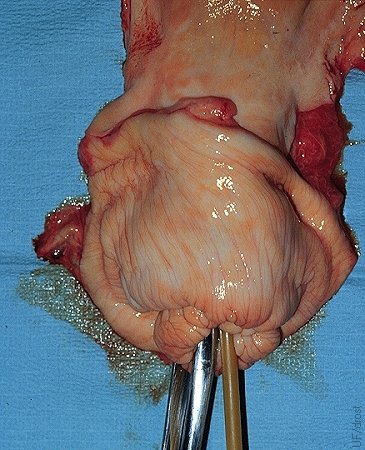
Forceps Cervical y Catéteres.
Uno de las tenazas del forceps cervical se inserta directamente dentro del canal cervical. Después de la retracción del cervix, el catéter Foley se introduce por el lado del extremo de la pinza.
Drost M (1975)

Cilindro Graduado.
Un cilindro graduado estéril de 500 ml o 1000 ml se puede usar para colectar el medio de lavado. Los embriones se dejarán sedimentar por gravedad. Después de una espera de 15 minutos la porción superior del fluido puede ser sifóneada suavemente al introducir un tubo de diámetro pequeño hasta la marca de 50 mm. El resto del volumen más pequeño puede ser colocado en un plato de búsqueda para examinar bajo un microscopio la presencia de embriones. Este método es menos costoso que el uso de los filtros desechables de embriones de uso único.
Drost M (1980)

Filtro de Embriones.
Filtro de embriones (EmCon) con un tamiz de acero inoxidable. El diámetro de los poros es de 75 micrómetros. La pinza blanca en el tubo de drenaje controla el nivel del medio de lavado en el filtro. El tubo del efluente del catéter de lavado puede ser conectado directamente en la punta de la tapa del filtro.
Drost M (1980)
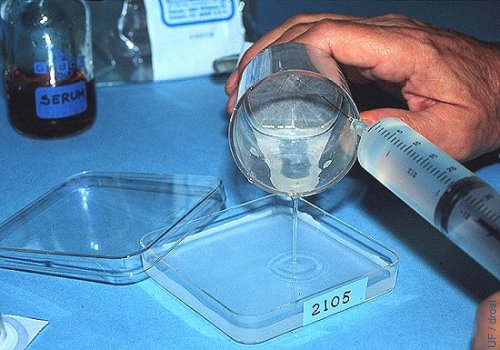
Lavado del Filtro.
El filtro se lava con medio de lavado (sin suero) para evitar la espuma. Una aguja de 25 ga se usa y el contenido del filtro se deposita en el plato de búsqueda con una rejilla que es marcado con el número de la donadora.
Drost M (1980)
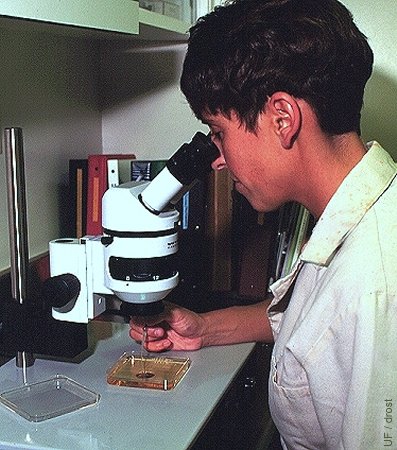
Buscando Embriones.
Búsqueda de embriones bajo un estereoscopio a una magnificación de 40 a 70 X.
Drost M (1995)
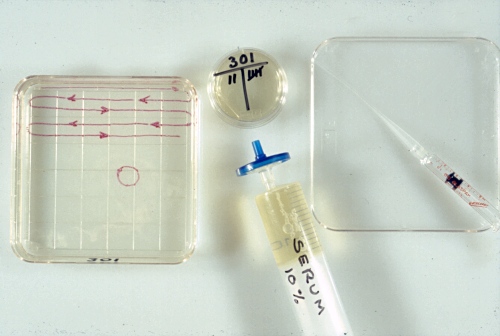
Plato de Búsqueda.
El plato de búsqueda, cuadrado y estéril, se llena hasta la mitad con medio de lavado que contiene 1% de suero fetal bovino. El medio de mantenimiento en el plato redondo contiene 10% de suero fetal bovino.
Drost M (1980)

Patrón de Búsqueda.
El círculo indica el tamaño del campo de visión a una magnificación de 70 X. Se realiza una búsqueda sistemática por la parte superior de los cuadrados de 1cm de izquierda a derecha, y después por la parte inferior de derecha a izquierda. El número de la donadora se escribe en la parte inferior del plato de búsqueda.
Drost M (1980)

Pistola para Transferir el Embrión.
Comparación de una pistola de transferencia de 21 pulgadas (53 cm) con una pistola de inseminación de 18 pulgadas (45 cm).
Drost M (1980)

Pistola de Inseminación de 0.25 cc.
Pistola de IA de 0.25 cc con un anillo O y funda con terminación partida. También se muestra una pajilla de 0.25 cc cargada con un embrión en la columna central de medio, entre dos paquetes de aire.
Drost M (1974)
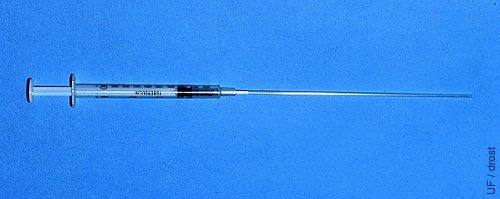
Jeringa de Tuberculina con Pajilla.
El extremo de algodón de una pajilla estéril de 0.25 cc se inserta directamente en la punta de una jeringa de tuberculina de 1.0 ml.
Drost M (1980)
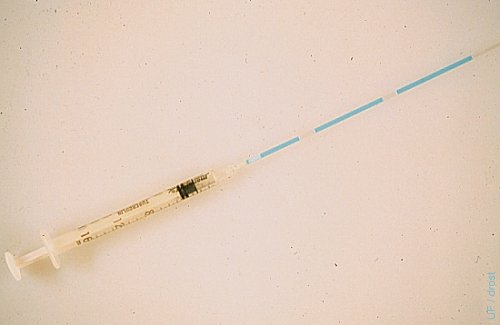
Pajilla Cargada con el Embrión.
Una pajilla estéril de 0.25 cc se fija a un jeringa de tuberculina de 1 ml insertando el extremo del tapón de algodón directamente en la punta de la jeringa. Después de lavar la pajilla con el medio de transferencia estéril, la pajilla se carga secuencialmente con dos columnas de medio de 2 cm, una columna de 1 cm de aire, una columna de 3 cm de medio conteniendo el embrión, una columna de 1 cm de aire, y una columna de 2 cc de medio.
Drost M (1980)

Pistola de ET con Funda Sanitaria.
Comparación de una pistola de transferencia de 53 cm con una pistola de inseminación estándar de 45 cm. La pistola de transferencia está cubierta con una funda sanitaria.
Drost M (1980)
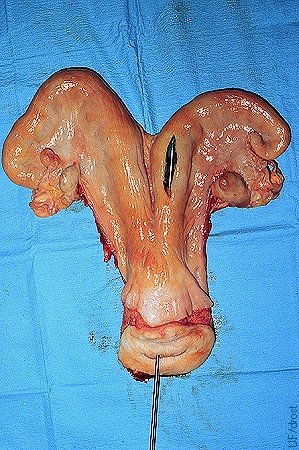
Colocación no-Quirúrgica del Embrión.
Localización preferida para la colocación no-quirúrgica del embrión en el cuerno ipsilateral al cuerpo lúteo, a nivel de la bifurcación externa del cuerno, aproximadamente a un tercio del extremo superior del cuerno. La punta del instrumento de transferencia se puede ver a través de la incisión en este espécimen de matadero. Una ubicación más profunda podría ser ideal, pero la excesiva manipulación y el trauma del endometrio deben ser evitados.
Drost M (1980)
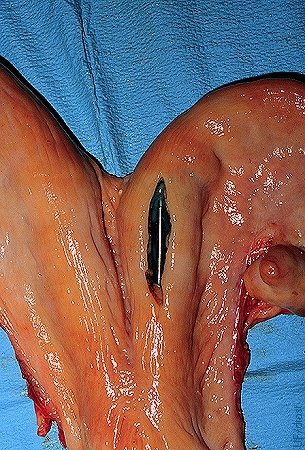
Colocación no-Quirúrgica del Embrión.
Localización preferida para la colocación no-quirúrgica del embrión en el cuerno ipsilateral al cuerpo lúteo, a nivel de la bifurcación externa del cuerno.
Drost M (1980)
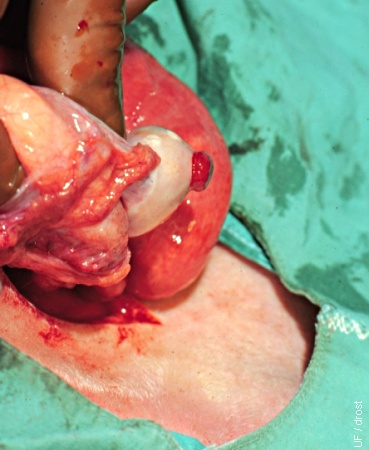
Transferencia Quirúrgica al Día 3.
El cuerpo hemorrágico al Día 3 se evalúa directamente, visualmente durante una transferencia quirúrgica.
Drost M (1974)
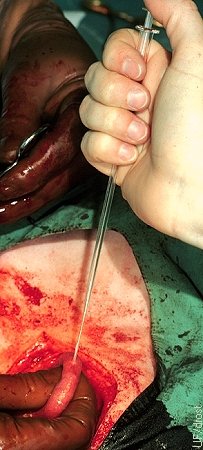
Colocación Quirúrgica del Embrión.
La localización preferida para la ubicación quirúrgica del embrión es en la punta del cuerno ipsilateral al cuerpo lúteo, a 5-10 cm de la unión útero-tubal.
Drost M (1974)

Transferencia por el Flanco.
Transferencia quirúrgica por la fosa paralumbar en la punta del cuerno derecho ipsilateral al ovario que lleva el cuerpo lúteo, que se ha identificado por palpación transrectal antes de la cirugía.
Drost M (1974)
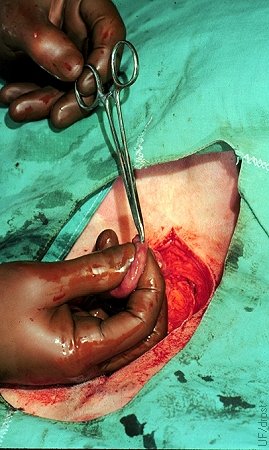
Sitio de Transferencia Quirúrgica.
Se realiza una incisión con unas pinzas mosquito en la curvatura mayor del cuerno uterino. La irrigación es mínima en esta ubicación. Subsecuentemente, el embrión se introduce con un catéter urinario de gato y es depositado en el lumen 2 a 3 cm apartado de la incisión para evitar contacto con sangre o suero.
Drost M (1974)

Unidad de Congelación de Embriones.
Unidad de congelación de embriones programable.
Drost M (1980)
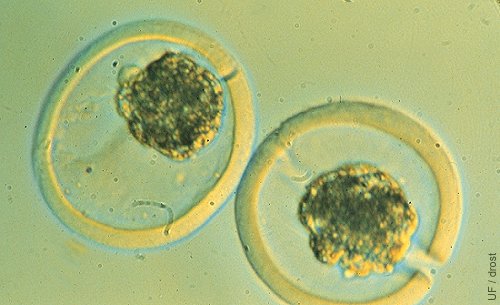
Partición del Embrión.
Dos semi-embriones después de la partición de una morula. Un semi-embrión se ubica en una zona pelúcida vacía sustituta. Note las hendiduras en las zonas pelúcidas.
Seidel GE (1984)

Gemelos Idénticos.
Dos pares de gemelos idénticos producidos por partición de embriones en la Universidad del Estado de Colorado.
Seidel GE (1984)